Vertex, une société de biotechnologie spécialisée dans la création de thérapies médicales, et CRISPR Therapeutics, une société détenue par l'un des découvreurs de la technologie d'édition de gènes CRISPR/Cas9, ont obtenu l'approbation de la FDA des États-Unis pour la première thérapie CRISPR/Cas9 au monde, CASGEVY, destinée à traiter la drépanocytose.
La drépanocytose handicape les personnes touchées en raison de la malformation de l'hémoglobine dans les cellules sanguines, ce qui entraîne une anémie, des problèmes de circulation sanguine, des lésions de la rate, et bien plus encore. Les solutions actuelles s'attaquent principalement aux symptômes à court terme tels que la douleur aiguë(comme celle-ci chez Amazon). La maladie est causée par des erreurs dans les gènes de l'ADN hérités des parents, et de nombreuses personnes en meurent avant l'âge de 45 ans.
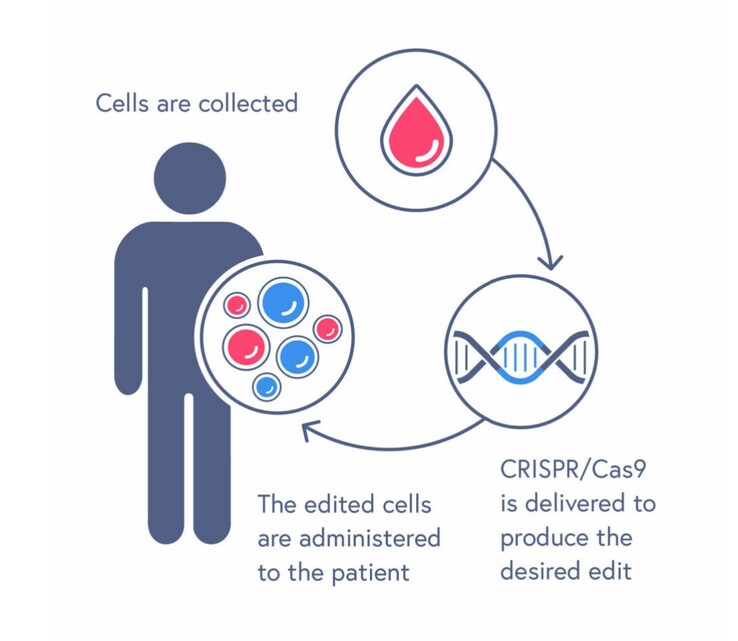
CRISPR/Cas9 a été inventé en 2012 et est une technologie d'édition de gènes récompensée par un prix Nobel qui permet de localiser, de couper et d'éditer facilement des régions spécifiques des gènes. CASGEVY utilise cette technologie pour éliminer les erreurs dans les cellules souches sanguines extraites d'un patient, puis réinsère ces cellules dans le corps pour guérir la maladie. Cependant, CASGEVY n'est pas sans risques. Comme il faut d'abord recourir à la chimiothérapie pour éliminer toutes les mauvaises cellules sanguines de la moelle osseuse avant la transplantation, les décès et les complications sont fréquents.
CASGEVY (exagamglogene autotemcel ou exa-cel) est un traitement unique pour les personnes âgées de plus de 12 ans qui peut réduire considérablement ou éliminer la drépanocytose. L'utilisation de ce traitement a été approuvée au Bahreïn, en Angleterre, en Écosse et au Pays de Galles en novembre 2023 et en Amérique en décembre 2023.
Top 10
» Le Top 10 des PC portables multimédia
» Le Top 10 des PC portables de jeu
» Le Top 10 des PC portables de jeu légers
» Le Top 10 des ordinateurs portables bureautiques
» Le Top 10 des PC portables bureautiques premium/professionnels
» Le Top 10 des Stations de travail mobiles
» Le Top 10 des Ultraportables
» Le Top 10 des Ultrabooks
» Le Top 10 des Convertibles
» Le Top 10 des Tablettes
» Le Top 10 des Tablettes Windows
» Le Top 10 des Smartphones
» Le Top 10 des PC Portables á moins de 300 euros
» Le Top 10 des PC Portables á moins de 500 euros
» Le Top 25 des meilleurs écrans d'ordinateurs
Source(s)
8 décembre 2023
Vertex et CRISPR Therapeutics annoncent l'approbation par la FDA américaine de CASGEVY™ (exagamglogene autotemcel) pour le traitement de la drépanocytose
- Première approbation d'une thérapie d'édition de gènes basée sur CRISPR aux États-Unis -
- Environ 16 000 patients âgés de 12 ans et plus atteints de drépanocytose sévère peuvent désormais être éligibles à ce traitement ponctuel -
- Plusieurs centres de traitement autorisés activés -
BOSTON & ZUG, Suisse--(BUSINESS WIRE)--Dec. 8, 2023-- Vertex Pharmaceuticals Incorporated (Nasdaq : VRTX) et CRISPR Therapeutics (Nasdaq : CRSP) ont annoncé aujourd'hui que la U.S. Food and Drug Administration (FDA), l'agence américaine de santé publique, a approuvé le traitement de la drépanocytose. Food and Drug Administration (FDA) a approuvé CASGEVY™ (exagamglogene autotemcel [exa-cel]), une thérapie cellulaire à édition génomique CRISPR/Cas9, pour le traitement de la drépanocytose chez les patients âgés de 12 ans et plus présentant des crises vaso-occlusives (VOC) récurrentes. Cette autorisation signifie que pour la première fois, environ 16 000 patients atteints de drépanocytose peuvent bénéficier d'un traitement durable et unique qui offre la possibilité d'une guérison fonctionnelle de leur maladie en éliminant les COV sévères et les hospitalisations causées par les COV sévères.
"L'approbation de CASGEVY par la FDA est capitale : il s'agit de la première thérapie d'édition de gènes basée sur CRISPR à être approuvée aux États-Unis. De plus, CASGEVY est le premier traitement de sa catégorie qui offre le potentiel d'une thérapie unique transformatrice pour les patients éligibles atteints de drépanocytose ", a déclaré Reshma Kewalramani, M.D., présidente-directrice générale et présidente de Vertex. "Je tiens à exprimer ma profonde gratitude aux patients et aux chercheurs dont la confiance dans ce programme a ouvert la voie à cette approbation historique."
"Lorsque notre société a été fondée, nous avions la vision de traduire la technologie CRISPR en de multiples thérapies révolutionnaires. Ainsi, cette approbation aux États-Unis du tout premier médicament utilisant l'édition de gènes CRISPR est à couper le souffle, et un moment d'humilité pour moi personnellement et pour toute l'organisation", a déclaré Samarth Kulkarni, Ph.D., président-directeur général de CRISPR Therapeutics.
"Il a été remarquable de participer à ce programme révolutionnaire", a déclaré Stephan Grupp, M.D., Ph.D., chef de la section de thérapie cellulaire et de transplantation et directeur du Kelly Center for Cancer Immunotherapy à l'hôpital pour enfants de Philadelphie, et président du comité de pilotage du programme clinique CLIMB-121. "CASGEVY a le potentiel d'être un traitement transformateur pour les patients, et je suis impatient de poursuivre le travail pour s'assurer que les patients éligibles puissent avoir accès à cette thérapie à travers le pays."
L'administration de CASGEVY nécessite une expérience spécialisée dans la transplantation de cellules souches ; par conséquent, Vertex s'engage avec des hôpitaux expérimentés à établir un réseau de centres de traitement autorisés (ATC) indépendants à travers les États-Unis pour offrir CASGEVY aux patients. Les ATC suivants sont déjà activés :
Boston Medical Center à Boston, Mass.
Children's National Hospital à Washington, D.C.
City of Hope Children's Cancer Center à Los Angeles (Californie)
Hôpital pour enfants Medical City à Dallas, Texas
Methodist Children's Hospital à San Antonio, Texas
L'hôpital pour enfants Nationwide à Columbus, dans l'Ohio
The Children's Hospital at TriStar Centennial à Nashville, Tenn.
The Ohio State University Comprehensive Cancer Center - James Cancer Hospital and Solove Research Institute à Columbus, Ohio
L'hôpital pour enfants de l'université de Chicago/Comer à Chicago (Illinois).
D'autres ATC seront activés dans les semaines à venir et une liste complète des ATC, y compris les mises à jour suite à l'approbation, peut être consultée sur CASGEVY.com.
À propos de CASGEVY™ (exagamglogene autotemcel [exa-cel])
CASGEVY est une thérapie cellulaire à génome modifié consistant en des cellules souches hématopoïétiques (CSH) CD34+ autologues éditées par la technologie CRISPR/Cas9 au niveau de la région enhancer spécifique aux érythroïdes du gène BCL11A. CASGEVY est destiné à une administration unique dans le cadre d'une procédure de transplantation de cellules souches hématopoïétiques au cours de laquelle les cellules CD34+ du patient sont modifiées pour réduire l'expression de BCL11A dans les cellules de la lignée érythroïde, ce qui entraîne une augmentation de la production d'hémoglobine fœtale (HbF). L'HbF est la forme d'hémoglobine porteuse d'oxygène naturellement présente pendant le développement du fœtus, qui passe ensuite à la forme adulte de l'hémoglobine après la naissance. Il a été démontré que CASGEVY réduit ou élimine les crises vaso-occlusives chez les patients atteints de DICS.
CASGEVY a reçu une autorisation conditionnelle de mise sur le marché en Grande-Bretagne par l'Agence britannique de réglementation des médicaments et des produits de santé (U.K. Medicines and Healthcare products Regulatory Agency) et par l'Autorité nationale de réglementation de la santé (National Health Regulatory Authority) à Bahreïn pour les patients âgés de 12 ans et plus atteints de DICS caractérisée par des crises vaso-occlusives récurrentes ou de bêta-thalassémie transfusionnelle (TDT), pour lesquels une greffe de cellules souches hématopoïétiques est appropriée et un donneur de cellules souches hématopoïétiques apparenté et compatible avec l'antigène des leucocytes humains n'est pas disponible. CASGEVY fait actuellement l'objet d'un examen par l'Agence européenne des médicaments et l'Agence saoudienne des aliments et des médicaments pour la DSC et le TDT.
L'utilisation de CASGEVY pour le traitement du TDT aux Etats-Unis reste expérimentale. Vertex a soumis une BLA à la FDA américaine pour l'utilisation potentielle de CASGEVY chez les patients âgés de 12 ans et plus atteints de TDT et s'est vu attribuer une date d'action cible en vertu de la Prescription Drug User Fee Act (PDUFA), soit le 30 mars 2024.
À propos de la collaboration Vertex/CRISPR Rapports financiers
Vertex dirige le développement, la fabrication et la commercialisation de CASGEVY à l'échelle mondiale avec le soutien de CRISPR Therapeutics. Parallèlement à l'approbation de CASGEVY par la FDA, Vertex versera à CRISPR un paiement d'étape de 200 millions de dollars, qui sera capitalisé et amorti dans le coût des ventes. En outre, Vertex enregistrera 100 % des revenus de CASGEVY, des coûts des ventes et des frais de vente, généraux et administratifs, et comptabilisera la part de 40 % de CRISPR dans les profits ou pertes nets de CASGEVY dans le coût des ventes. Enfin, Vertex comptabilisera 60 % des frais de recherche et de développement, déduction faite de la part de 40 % de CRISPR.
À propos de la drépanocytose
La drépanocytose est une maladie débilitante, progressive et qui raccourcit la vie. Les patients atteints de drépanocytose ont une qualité de vie bien inférieure à celle de la population générale, et le coût des soins de santé aux États-Unis pour la gestion de la drépanocytose chez les patients souffrant de COV récurrents est estimé entre 4 et 6 millions de dollars. La DSC est une maladie du sang héréditaire qui affecte les globules rouges, essentiels au transport de l'oxygène vers tous les organes et tissus de l'organisme. Cette maladie provoque des douleurs intenses, des lésions organiques et une réduction de la durée de vie en raison de la déformation ou de la "maladie" des globules rouges. La caractéristique clinique de la DICS est la présence de COV, qui sont causés par l'obstruction des vaisseaux sanguins par les globules rouges malades et qui entraînent des douleurs sévères et débilitantes pouvant survenir n'importe où dans le corps et à n'importe quel moment. La maladie de Creutzfeldt-Jakob nécessite un traitement à vie et réduit l'espérance de vie. Aux États-Unis, l'âge médian du décès des patients atteints de DICS est d'environ 45 ans. Aujourd'hui, la greffe de cellules souches provenant d'un donneur compatible est un moyen de guérir la maladie, mais cette option n'est accessible qu'à une petite fraction des patients atteints de la maladie, en raison du manque de donneurs disponibles.
Aider les patients dans leur parcours CASGEVY
Vertex Connects™ est un programme destiné aux patients américains éligibles auxquels CASGEVY a été prescrit. Grâce à Vertex Connects, des gestionnaires de soins sont disponibles pour fournir des ressources éducatives, des communications et un soutien pour naviguer dans le parcours de traitement, et une assistance supplémentaire est disponible pour les patients éligibles.
Pour obtenir de plus amples renseignements sur les CTA, le parcours thérapeutique de CASGEVY et Vertex Connects, composez le 1-833-VERTEX-5 (1-833-837-8395) - et apprenez-en davantage sur notre programme de soutien aux patients en visitant le site VertexConnects.com.
INDICATIONS ET RENSEIGNEMENTS IMPORTANTS SUR LA SÉCURITÉ DE CASGEVY (exagamglogene autotemcel) aux États-Unis
CASGEVY est un traitement unique utilisé pour traiter les personnes âgées de 12 ans et plus atteintes de drépanocytose (SCD) qui présentent des crises vaso-occlusives (VOC) fréquentes.
CASGEVY est fabriqué spécifiquement pour chaque patient, à partir des cellules souches du sang édité du patient, et augmente la production d'un type particulier d'hémoglobine appelé hémoglobine F (hémoglobine fœtale ou HbF). Une plus grande quantité d'HbF augmente le taux global d'hémoglobine et il a été démontré qu'elle améliore la production et la fonction des globules rouges. Cela peut éliminer les COV chez les personnes atteintes de DICS.
INFORMATIONS IMPORTANTES EN MATIÈRE DE SÉCURITÉ
Quelle est l'information la plus importante que je devrais connaître au sujet de CASGEVY ?
Après un traitement par CASGEVY, vous aurez moins de cellules sanguines pendant un certain temps, jusqu'à ce que CASGEVY s'implante (se greffe) dans votre moelle osseuse. Cela inclut de faibles taux de plaquettes (cellules qui aident habituellement le sang à coaguler) et de globules blancs (cellules qui combattent habituellement les infections). Votre médecin surveillera cette situation et vous donnera un traitement si nécessaire. Il vous informera lorsque les taux de cellules sanguines reviendront à des niveaux sûrs.
Informez immédiatement votre médecin si vous présentez l'un des symptômes suivants, qui pourraient être des signes d'un faible taux de cellules plaquettaires :
maux de tête sévères
ecchymoses anormales
saignement prolongé
saignements sans blessure tels que saignements de nez, saignements des gencives, sang dans les urines, les selles ou les vomissements, ou toux avec du sang
Informez immédiatement votre fournisseur de soins de santé si vous présentez l'un des symptômes suivants, qui pourraient être des signes d'un faible taux de globules blancs :
fièvre
frissons
infections
Vous pouvez ressentir des effets secondaires associés à d'autres médicaments administrés dans le cadre du traitement par CASGEVY. Parlez à votre médecin de ces effets secondaires possibles. Votre médecin peut vous donner d'autres médicaments pour traiter vos effets secondaires.
Comment vais-je recevoir CASGEVY ?
Votre professionnel de la santé vous donnera d'autres médicaments, y compris un médicament de conditionnement, dans le cadre de votre traitement par CASGEVY. Il est important de discuter avec votre médecin des risques et des bénéfices de tous les médicaments impliqués dans votre traitement.
Après avoir reçu le médicament de conditionnement, il se peut que vous ne puissiez pas être enceinte ou avoir un enfant. Vous devez discuter des options de préservation de la fertilité avec votre médecin avant le traitement.
ÉTAPE 1 : Avant le traitement par CASGEVY, un médecin vous administrera un médicament de mobilisation. Ce médicament fait passer les cellules souches sanguines de votre moelle osseuse dans la circulation sanguine. Les cellules souches sanguines sont ensuite recueillies dans une machine qui sépare les différentes cellules sanguines (c'est ce qu'on appelle l'aphérèse). L'ensemble de ce processus peut se dérouler plusieurs fois. Chaque fois, cela peut prendre jusqu'à une semaine.
Au cours de cette étape, des cellules de sauvetage sont également prélevées et conservées à l'hôpital. Il s'agit de vos cellules souches sanguines existantes, qui sont conservées sans être traitées, au cas où un problème surviendrait dans le processus de traitement. Si CASGEVY ne peut pas être administré après le traitement de conditionnement, ou si les cellules souches sanguines modifiées ne s'implantent pas (greffe) dans l'organisme, ces cellules de sauvetage vous seront restituées. Si vous recevez des cellules de secours, vous ne bénéficierez pas du traitement CASGEVY.
ÉTAPE 2 : Après avoir été prélevées, vos cellules souches sanguines seront envoyées au site de fabrication où elles seront utilisées pour produire CASGEVY. Il peut s'écouler jusqu'à 6 mois entre le moment où vos cellules sont prélevées et celui où CASGEVY est fabriqué et testé avant d'être renvoyé à votre médecin.
ÉTAPE 3 : Peu avant votre greffe de cellules souches, votre médecin vous donnera un médicament de conditionnement pour quelques jours d'hospitalisation. Cela vous préparera au traitement en éliminant les cellules de la moelle osseuse, afin qu'elles puissent être remplacées par les cellules modifiées de CASGEVY. Après l'administration de ce médicament, votre taux de cellules sanguines tombera à un niveau très bas. Vous serez hospitalisé pour cette étape et le resterez jusqu'à la fin de la perfusion de CASGEVY.
ÉTAPE 4 : Un ou plusieurs flacons de CASGEVY seront administrés dans une veine (perfusion intraveineuse) sur une courte période.
Après la perfusion de CASGEVY, vous resterez à l'hôpital afin que votre médecin puisse surveiller de près votre rétablissement. Cela peut prendre de 4 à 6 semaines, mais les délais peuvent varier. Votre médecin décidera du moment où vous pourrez rentrer chez vous.
Que dois-je éviter après avoir reçu CASGEVY ?
Ne donnez pas de sang, d'organes, de tissus ou de cellules à l'avenir
Quels sont les effets secondaires possibles ou raisonnablement probables de CASGEVY ?
Les effets secondaires les plus courants de CASGEVY sont les suivants :
Faible taux de plaquettes, ce qui peut réduire la capacité du sang à coaguler et provoquer des saignements
Un faible taux de globules blancs, ce qui peut vous rendre plus vulnérable aux infections
Votre médecin effectuera une analyse de votre sang pour vérifier la présence de faibles taux de cellules sanguines (y compris les plaquettes et les globules blancs). Informez immédiatement votre médecin si vous présentez l'un des symptômes suivants :
fièvre
frissons
infections
maux de tête sévères
ecchymoses anormales
saignement prolongé
saignements sans blessure, tels que saignements de nez, saignements des gencives, sang dans les urines, les selles ou les vomissements, ou encore toux sanguine
Ce ne sont pas tous les effets secondaires possibles de CASGEVY. Appelez votre médecin pour obtenir un avis médical sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Informations générales sur l'utilisation sûre et efficace de CASGEVY
Parlez à votre médecin de tout problème de santé.
Veuillez consulter les informations de prescription complètes, y compris les informations destinées aux patients pour CASGEVY.
À propos de Vertex
Vertex est une société de biotechnologie internationale qui investit dans l'innovation scientifique afin de créer des médicaments transformateurs pour les personnes atteintes de maladies graves. La société a approuvé des médicaments qui traitent les causes sous-jacentes de plusieurs maladies génétiques chroniques qui raccourcissent la vie - la mucoviscidose, la drépanocytose et la bêta-thalassémie dépendante des transfusions - et continue de faire progresser les programmes cliniques et de recherche sur ces maladies. Vertex dispose également d'un solide portefeuille clinique de thérapies expérimentales dans toute une série de modalités pour d'autres maladies graves pour lesquelles elle a une connaissance approfondie de la biologie humaine causale, notamment les maladies rénales médiées par APOL1, les douleurs aiguës et neuropathiques, le diabète de type 1 et le déficit en alpha-1-antitrypsine.
Vertex a été fondée en 1989 et a son siège mondial à Boston, ainsi qu'un siège international à Londres. La société possède également des sites de recherche et de développement et des bureaux commerciaux en Amérique du Nord, en Europe, en Australie et en Amérique latine. Vertex est régulièrement reconnue comme l'un des meilleurs employeurs du secteur, et figure notamment depuis 14 années consécutives sur la liste des meilleurs employeurs du magazine Science, ainsi que sur la liste des 100 meilleures entreprises pour lesquelles travailler établie par Fortune. Pour obtenir des mises à jour sur la société et en savoir plus sur l'histoire de l'innovation de Vertex, visitez le site www.vrtx.com ou suivez-nous sur LinkedIn, Facebook, Instagram, YouTube et Twitter/X.
À propos de CRISPR Therapeutics
CRISPR Therapeutics est une société leader dans le domaine de l'édition de gènes qui se concentre sur le développement de médicaments transformateurs basés sur les gènes pour les maladies graves en utilisant sa plateforme propriétaire CRISPR/Cas9. CRISPR/Cas9 est une technologie révolutionnaire d'édition de gènes qui permet d'apporter des modifications précises et ciblées à l'ADN génomique. CRISPR Therapeutics a établi un portefeuille de programmes thérapeutiques dans un large éventail de domaines pathologiques, notamment les hémoglobinopathies, l'oncologie, la médecine régénérative et les maladies rares. Pour accélérer et développer ses efforts, CRISPR Therapeutics a établi des collaborations stratégiques avec des entreprises de premier plan, notamment Bayer, Vertex Pharmaceuticals et ViaCyte, Inc. CRISPR Therapeutics AG a son siège à Zoug, en Suisse, et sa filiale américaine à 100 %, CRISPR Therapeutics Inc. et ses activités de R&D à Boston, dans le Massachusetts, et à San Francisco, en Californie, ainsi que ses bureaux d'affaires à Londres, au Royaume-Uni. Pour plus d'informations, veuillez consulter le site www.crisprtx.com.
La marque verbale CRISPR THERAPEUTICS® et son design sont des marques commerciales et des marques déposées de CRISPR Therapeutics AG. Toutes les autres marques et marques déposées sont la propriété de leurs détenteurs respectifs.
Note spéciale de Vertex concernant les déclarations prospectives
Ce communiqué de presse contient des énoncés prospectifs tels que définis dans le Private Securities Litigation Reform Act de 1995, tel que modifié, y compris, sans s'y limiter, les énoncés de Reshma Kewalramani, M.D., Samarth Kulkarni, Ph.D., et Stephan Grupp, M.D., Ph.D., et les énoncés concernant la population anticipée de patients admissibles à CASGEVY aux États-Unis, les attentes concernant les avantages potentiels de CASGEVY, les attentes selon lesquelles d'autres ATC seront activés au cours des prochaines semaines, le plan de Vertex d'effectuer des paiements d'étape à CRISPR et le traitement comptable prévu par Vertex pour les paiements d'étape, les revenus prévus, le coût des ventes, les dépenses et les profits ou pertes nets liés à CASGEVY. Bien que Vertex estime que les énoncés prospectifs contenus dans ce communiqué de presse sont exacts, ces énoncés prospectifs représentent les croyances de la société uniquement à la date de ce communiqué de presse et il existe un certain nombre de risques et d'incertitudes qui pourraient faire en sorte que les événements ou les résultats réels diffèrent matériellement de ceux exprimés ou sous-entendus par ces énoncés prospectifs. Ces risques et incertitudes comprennent, entre autres, le fait que les données provenant des programmes de développement de la société pourraient ne pas appuyer l'enregistrement ou le développement ultérieur de ses composés pour des raisons d'innocuité, d'efficacité ou autres, que l'obtention de l'approbation et la commercialisation de CASGEVY en Europe et au Royaume d'Arabie Saoudite pourraient ne pas se produire dans les délais prévus, ou ne pas se produire du tout, ainsi que d'autres risques énumérés à la rubrique " Facteurs de risque " du plus récent rapport annuel de Vertex et des documents subséquents déposés auprès de la Securities and Exchange Commission à l'adresse www.sec.gov et disponibles sur le site Web de la société à l'adresse www.vrtx.com. Vous ne devez pas accorder une confiance excessive à ces déclarations ou aux données scientifiques présentées. Vertex décline toute obligation de mettre à jour les informations contenues dans ce communiqué de presse à mesure que de nouvelles informations deviennent disponibles.
Déclaration prospective de CRISPR Therapeutics
Ce communiqué de presse peut contenir un certain nombre de "déclarations prospectives" au sens du Private Securities Litigation Reform Act de 1995, tel que modifié, y compris les déclarations faites par Reshma Kewalramani, M.D., Samarth Kulkarni, Ph.D., et Stephan Grupp, M.D., Ph.D., dans ce communiqué de presse, ainsi que les déclarations faites par Vertex dans le cadre de ses activités de recherche, dans ce communiqué de presse, ainsi que les déclarations concernant CRISPR Therapeutics : (i) les plans et les attentes concernant la commercialisation de CASGEVY et les avantages prévus de CASGEVY, y compris la population de patients admissibles à CASGEVY aux États-Unis et l'accès des patients à CASGEVY ; (ii) les attentes concernant les essais cliniques exa-cel en cours, y compris les implications potentielles des données cliniques pour les patients ; (iii) les délais et les attentes concernant les décisions supplémentaires des organismes de réglementation ; (iv) la réception du paiement d'étape de Vertex ; et (v) les attentes concernant la valeur thérapeutique, le développement et le potentiel commercial des technologies et des thérapies d'édition de gènes CRISPR/Cas9. Sans limiter la portée de ce qui précède, les mots " croire ", " anticiper ", " planifier ", " s'attendre à " et autres expressions similaires ont pour but d'identifier les déclarations prospectives. Vous êtes averti que les déclarations prospectives sont intrinsèquement incertaines. Bien que CRISPR Therapeutics estime que ces déclarations sont basées sur des hypothèses raisonnables dans les limites de sa connaissance de son activité et de ses opérations, les investisseurs existants et potentiels sont avertis que les déclarations prospectives sont intrinsèquement incertaines, ne sont ni des promesses ni des garanties et ne doivent pas accorder une confiance excessive à ces déclarations, qui ne sont valables qu'à la date à laquelle elles ont été faites. Les performances et résultats réels peuvent différer matériellement de ceux projetés ou suggérés dans les déclarations prévisionnelles en raison de divers risques et incertitudes. Ces risques et incertitudes comprennent, entre autres, que : les données cliniques issues des essais cliniques en cours d'exa-cel ne se poursuivront pas ou ne seront pas répétées dans les essais cliniques en cours ou prévus, ou pourraient ne pas soutenir l'approbation réglementaire ou le renouvellement de l'autorisation conditionnelle ; l'approbation réglementaire dans d'autres juridictions pourrait ne pas se produire dans les délais prévus ou ne pas se produire du tout ; une tarification ou un remboursement adéquats pourraient ne pas être garantis pour soutenir la poursuite du développement ou la commercialisation d'exa-cel après l'approbation réglementaire ; de futurs facteurs concurrentiels ou d'autres facteurs de marché pourraient avoir un effet négatif sur le potentiel commercial de CASGEVY ; CRISPR Therapeutics pourrait ne pas réaliser les bénéfices potentiels de sa collaboration avec Vertex ; il existe des incertitudes concernant la protection de la propriété intellectuelle pour la technologie de CRISPR Therapeutics et la propriété intellectuelle appartenant à des tiers ; et ces risques et incertitudes décrits sous le titre "Facteurs de risque" dans le rapport annuel le plus récent de CRISPR Therapeutics sur le formulaire 10-K, le rapport trimestriel sur le formulaire 10-Q, et dans tout autre dépôt ultérieur effectué par CRISPR Therapeutics auprès de la U. S. Securities and Exchange Commission, qui sont décrits dans le rapport annuel le plus récent de CRISPR Therapeutics sur le formulaire 10-K.Securities and Exchange Commission des États-Unis, qui sont disponibles sur le site web de la SEC à l'adresse www.sec.gov. CRISPR Therapeutics décline toute obligation ou engagement de mettre à jour ou de réviser les déclarations prospectives contenues dans ce communiqué de presse, sauf dans la mesure requise par la loi.
Voir la version source sur businesswire.com : www.businesswire.com/news/home/20231208951733/en/
Vertex Pharmaceuticals Incorporated
Investisseurs :
ou
Manisha Pai, +1 617-961-1899
Médias :
ou
International : +44 20 3204 5275
ou
ÉTATS-UNIS : 617-341-6992
ou
Heather Nichols : +1 617-839-3607
CRISPR Therapeutics
Investisseurs :
Susan Kim, +1 617-307-7503
Médias :
Rachel Eides, +1-617-315-4493
Source : Vertex Pharmaceuticals Incorporated Vertex Pharmaceuticals Incorporated